【Cell】发现细胞中mRNA自我摧毁机制
Cell:发现细胞中mRNA自我摧毁机制
2011/12/27 19:24:24
美国叶史瓦大学艾伯特-爱因斯坦医学院研究人员发现细胞利用第一个已知的机制控制mRNA的存活。这些关于mRNA的发现可能对逆转癌症不受调控的细胞分裂提供启示。2011年12月22日,该研究发表在《细胞》期刊上。该研究通信作者Robert Singer博士说,“我们研究的mRNA分子命运类似希腊悲剧。它们的命运在诞生那一刻就被决定了。”
该研究是利用Singer博士之前开发出的高级显微镜技术在酵母细胞中开展的,该技术也是第一次允许科学家在单个细胞中实时观察单个分子。制造蛋白的指令编码在基因的DNA序列上,而基因则是位于每个细胞核染色体中。但是要制造蛋白,基因的DNA编码必须拷贝或者说转录到mRNA分子上,然后mRNA从细胞核迁移到细胞蛋白制造工厂所在的细胞质。因为一旦mRNA存在,它就能够作为模板制造蛋白。因此科学家长期以来就怀疑当一种蛋白水平积累到危害的程度时细胞必须存在降解mRNA的方法。Singer博士说,“细胞在这个时候会以某种方式摧毁的mRNA,但是没有人知道这是如何发生的。”
在他们寻求这种机制时,Singer博士和他的同事们集中注意在两种基因_SWI5和_CLB2,它们编码的蛋白调节细胞周期—细胞分裂期间复杂的一系列步骤,首先复制它的遗传物质,然后将遗传物质均匀地分配到两个子细胞中。为了合适地规划细胞周期,_SWI5_和_CLB2_基因编码的蛋白水平必须得到精致控制,这就意味着这两种基因制造的mRNA将是有目的降解的首要候选物。
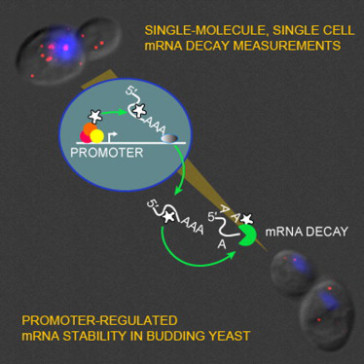
引人注目的是,研究人员发现这些mRNA事实上携带着最终将自己摧毁的分子“自我摧毁定时器(self-destruct timer)”。当基因被转录时,称作启动子区域的基因部分起着打开基因的作用,这样DNA将被拷贝到mRNA上。这些艾伯特-爱因斯坦医学院研究人员发现_SWI5_和_CLB2_启动子区域也有其他作用:它们招募一种蛋白Dbf2p,这样当mRNA分子被合成时,Dbf2p就与它们结合。这些mRNA–由_SWI5_和_CLB2_基因转录而来而且携带Dbf2p蛋白—就使得它们从细胞核运输到细胞质。在细胞质中,蛋白Dbf20p通过与Dbf2p连接在一起以便搭上mRNA分子,而且这两种蛋白一起就导致这些mRNA分子快速降解。
Singer说,“我们的发现表明蛋白水平必须得到仔细控制,制造蛋白的基因含有启动子区域,正是该启动子区域在mRNA分子刚产生的时候就决定着它们死亡的命运,而且启动子区域是通过招募蛋白Dbf2p—mRNA合成和它的最终降解之间常见因子—来标记新制造的mRNA来行使的。Dbf2p在mRNA诞生开始就与mRNA附着在一起,然后在接收到指示不应当制造更多蛋白的信号后作出应答,从而下达摧毁mRNA的命令。”Singer说,尽管这些观察都是与酵母细胞相关,但是他相信这种控制人mRNA降解的过程“将也是非常类似的”,可能用于对抗癌症。他注意到,“人们一旦获得对控制细胞周期和细胞分裂的机制新认识,就可以提出针对性的治疗方法来调节癌症中不受控制的细胞分裂。”
Single-Molecule mRNA Decay Measurements Reveal Promoter- Regulated mRNA Stability in Yeast
Tatjana Trcek, Daniel R. Larson, Alberto Moldón, Charles C. Query, Robert H. Singer
Singer Messenger RNA decay measurements are typically performed on a population of cells. However, this approach cannot reveal sufficient complexity to provide information on mechanisms that may regulate mRNA degradation, possibly on short timescales. To address this deficiency, we measured cell cycle-regulated decay in single yeast cells using single-molecule FISH. We found that two genes responsible for mitotic progression, SWI5 and CLB2, exhibit a mitosis-dependent mRNA stability switch. Their transcripts are stable until mitosis, when a precipitous decay eliminates the mRNA complement, preventing carryover into the next cycle. Remarkably, the specificity and timing of decay is entirely regulated by their promoter, independent of specific cis mRNA sequences. The mitotic exit network protein Dbf2p binds to SWI5 and CLB2 mRNAs cotranscriptionally and regulates their decay. This work reveals the promoter-dependent control of mRNA stability, a regulatory mechanism that could be employed by a variety of mRNAs and organisms.